Учебник по физике для поступающих в ВУЗ
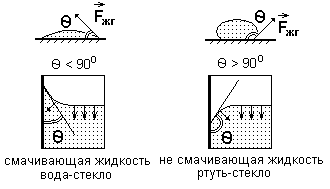
Мениск зависит от того, смачивает или не смачивает жидкость стенки сосуда.
Угол смачивания θ – угол между плоскостью, касательной к поверхности жидкости, и стенкой.
Для смачивающей жидкости угол смачивания острый θ < 90o
Для несмачивающей жидкости угол смачивания тупой θ < 90o
В широких сосудах силы притяжения между молекулами твердого тела и жидкости удерживают в виде мениска лишь незначительную часть жидкости. Основная поверхность – горизонтальная. В узких сосудах (капиллярах) масса жидкости невелика и наблюдается явление капиллярности.
Капиллярность – явление подъема или опускания жидкости в капиллярах.
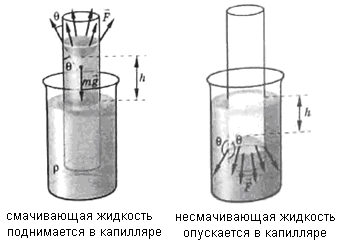
Смачивающая жидкость поднимается в каппиляре. Fжт > Fж
Несмачивающая жидкость опускается в капилляре. Fжт < Fж
Подъем жидкости в капилляре происходит пока результирующая сила, действующая на жидкость вверх, не уравновесится силой тяжести столба жидкости высотой h:
Fв = mg
Жидкость, не смачивающая стенки капилляра, опускается в нем на расстояние h.
Согласно третьему закону Ньютона сила Fв, действующая на жидкость, равна силе поверхностного натяжения Fпов, действующей на стенку по линии соприкосновения ее с жидкостью:
Fв = Fпов
Fв = mg (вес столба жидкости в капилляре)
Fпов = σ 2πr
2πr - длина контура окружности капилляра
σ – поверхностное натяжение жидкости (См.выше «Поверхностное натяжение»)
Масса жидкости m = ρV = ρ πr2h
ρ – плотность жидкости
Высота подъема жидкости в капилляре( учитывая что σ 2πr = ρ πr2h g) :
h =
Высота подъема жидкости в капилляре зависит от свойств жидкости (ее поверхностного натяжения σ и плотности ρ)
Чем меньше радиус капилляра, тем выше высота подъема жидкости в капилляре.
КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА (уч.10кл.стр.312-317)
Деление тел по характеру относительного расположения частиц
Определение кристаллической решетки
Определение монокристалла и поликристалла. Примеры
Типы кристаллических решеток
Полиморфизм
Анизотропия
Изотропия
Физические свойства веществ различной кристаллической структуры
Определение аморфных тел. Примеры
Композиты
По характеру взаимного расположения частиц твердые тела делятся на три вида:
- кристаллические
- аморфные
- композиты
Принадлежность к тому или иному виду определяется химическим составом.
Кристаллы – это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Кристаллическая решетка – пространственная структура с регулярным, периодически повторяющимся расположением частиц.
Положения равновесия, относительно которых происходят тепловые колебания частиц, являются узлами кристаллической решетки.
Различаются четыре типа кристаллической решетки:
1) Ионные кристаллы – большинство неорганических соединений, например соли, окиси металлов;
2) Атомные кристаллы – кристаллические решетки полупроводников, многие органические твердые тела;
3) Молекулярные кристаллы – бром, метан, нафталин, парафин, многие твердые органические соединения;
4) Металлические кристаллы – металлы.
Монокристалл – твердое тело, частицы которого образуют единую кристаллическую решетку.
Поликристалл – твердое тело, состоящее из беспорядочно ориентированных монокристаллов.
Полиморфизм – существование различных кристаллических структур у одного и того же вещества.
Пример – алмаз, графит, фурелен – три разновидности углерода.
Кристаллы по разному проводят теплоту и ток в различных направлениях. От направления зависят и оптические свойства кристаллов.
Физические свойства кристаллических тел неодинаковы в различных направлениях.
Это свойство кристаллов называется анизотропностью или анизотропией
(греческое «анизос» – неравный, «тропос» – направление)
Анизотропия – зависимость физических свойств от направления внутри кристалла.
Изотропия – независимость физических свойств вещества от направления.
Анизотропия объясняется неодинаковой плотностью расположения частиц в кристаллической решетке в разных направлениях. Практически все кристаллические тела анизотропны.
Анизотропия механических, тепловых, электрических и оптических свойств кристаллов объясняется тем, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям.
Каждый маленький монокристалл поликристаллического тела анизотропен, но поликристаллическое тело изотропно.
Не все твердые тела – кристаллы.
Аморфные тела - твердые тела, для которых характерно неупорядоченное расположение частиц в пространстве.
Аморфные тела не имеют определенной формы в своей структуре строения атома или молекулы, не имеют кристаллической решетки, обладают свойством изотропии.
Все аморфные тела изотропны.
В отличие от жидкостей подвижность частиц в аморфных телах мала. Перескоки из одного положения в другое редки. С ростом температуры перескоки частиц учащаются.
В отличие от кристаллических тел определенной температуры плавления у аморфных тел нет.
Аморфные тела при низких температурах по своим свойствам напоминают твердые тела.
При кратковременных внешних воздействиях аморфные тела ведут себя как твердые, при продолжительном воздействии – текут.
Они занимают промежуточное положение между жидкостями и твердыми телами.
Атомы и молекулы аморфных тел, как и в жидкости, имеют определенное время «оседлой» жизни – время колебаний около положения равновесия, но по сравнению с жидкостью это время велико.
Аморфные тела являются изотропными – у них нет строгого порядка в расположении атомов. Их, физические свойства одинаковы по всем направлениям.
Примерами аморфных тел могут служить куски затвердевшей смолы, янтарь, стекло, резина, пластмассы.
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100
