Учебник по физике для поступающих в ВУЗ
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Пар, не находящийся в динамическом равновесии со своей жидкостью, называется ненасыщенным паром.
Насыщенный пар при данной температуре имеет определённую плотность, называемую равновесной.
Это обусловливает неизменность равновесной плотности, а следовательно, и давления насыщенного пара от его объёма при неизменной температуре, поскольку уменьшение или увеличение объёма этого пара приводит к конденсации пара или к испарению жидкости соответственно.
Изотерма насыщенного пара при некоторой температуре в координатной плоскости Р, V представляет собой прямую, параллельную оси V.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться.
При ветре, который уносит молекулы жидкости, испарение происходит быстрее, так как меньше молекул возвращается обратно в жидкость.
С повышением температуры термодинамической системы жидкость - насыщенный пар число молекул, покидающих жидкость за некоторое время, превышает количество молекул, возвращающихся из пара в жидкость. Это продолжается до тех пор, пока возрастание плотности пара не приводит к установлению динамического равновесия при более высокой температуре. При этом увеличивается и давление насыщенных паров. Таким образом, давление насыщенных паров зависит только от температуры.
Столь быстрое возрастание давления насыщенного пара обусловлено тем, что с повышением температуры происходит рост не только кинетической энергии поступательного движения молекул, но и их концентрации, т.е. числа молекул в единице объема
При испарении жидкость покидают наиболее быстрые молекулы, вследствие чего средняя кинетическая энергия поступательного движения оставшихся молекул уменьшается, а следовательно, и температура жидкости понижается. Поэтому, чтобы температура испаряющейся жидкости оставалась постоянной, к ней надо непрерывно подводить определённое количество теплоты.
Количество теплоты, которое необходимо сообщить единице массы жидкости, для превращения её в пар при неизменной температуре называется удельной теплотой парообразования.
Удельная теплота парообразования зависит от температуры жидкости, уменьшаясь с её повышением.
При конденсации количество теплоты, затраченное на испарение жидкости, выделяется.
Конденсация – процесс превращения из газообразного состояния в жидкое.
Рассмотрим условия фазового перехода газ – жидкость.
У идеального газа средняя потенциальная энергия взаимодействия частиц много меньше средней кинетической энергии.
│Ep│<< kT
(Модуль использован потому, что для сил притяжения потенциальная энергия отрицательна)
Для образования жидкости из газа средняя потенциальная энергия притяжения молекул должна превышать их среднюю кинетическую энергию
│Ep│≥ kT
Физический смысл этого неравенства в том, что переход из газообразного в жидкое состояние возможен лишь при температуре, меньше некоторой критической температуры:
T < Tкр =
Критическая температура – максимальная температура, при которой пар превращается в жидкость.
Пар – газообразное состояние вещества при температуре ниже критической.
Газ при T>Tкр нельзя перевести в жидкое состояние.
Критическая температура зависит от потенциальной энергии взаимодействия молекул и потому различна для разных газов
С ростом внешнего давления при сжатии газа уменьшается среднее расстояние между частицами, возрастает сила притяжения между ними и соответственно средняя потенциальная энергия взаимодействия.
Рассмотрим сжижение пара при изотермическом сжатии при T<Tкр
Конденсация – переход пара из газообразного состояния в жидкое
Масса жидкости при конденсации при данном объеме постоянна благодаря равновесию двух встречных процессов: конденсации пара и испарению молекул жидкости.
Испарение – парообразование со свободной поверхности жидкости
Интенсивность процесса испарения увеличивается с возрастанием температуры жидкости. Поэтому динамическое равновесие между испарением и конденсацией при повышении температуры устанавливается при больших концентрациях молекул газа.
Насыщенный пар – пар, находящийся в термодинамическом равновесии со своей жидкостью.
Термодинамическое равновесие – число молекул пара, конденсирующихся за определенный промежуток времени, равно числу молекул жидкости, испаряющихся за это же время.
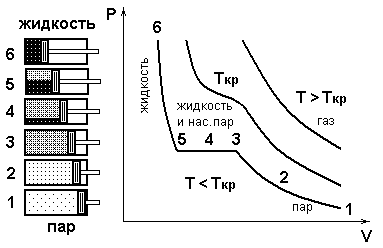
Концентрация частиц n постоянна, так как при уменьшении объема V в равной степени уменьшается полное количество частиц N из-за конденсации молекул пара.
Поэтому давление насыщенного пара p = nkT , когда в цилиндре сосуществуют пар и жидкость, остается постоянным (при изотермическом сжатии T = const)
После полной конденсации пара возможно незначительное сжатие жидкости. При этом давление резко возрастает из-за малой сжимаемости жидкости.
Изотерма при температуре выше критической T>Tкр совпадает с изотермой идеального газа.
Давление идеального газа при постоянной концентрации молекул возрастает прямо пропорционально абсолютной температуре.
Так как в насыщенном паре при возрастании температуры концентрация молекул увеличивается, давление насыщенного пара с повышением температуры возрастает быстрее, чем давление идеального газа с постоянной концентрацией молекул.
То есть давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара.
Главное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной температуре) меняется масса пара.
Энергетические процессы испарения и конденсации
Молекула испаряется с поверхности жидкости, если ее кинетическая энергия больше потенциальной энергии притяжения к другим молекулам:
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100
