Учебник по физике для поступающих в ВУЗ
Затем газ теплоизолируют от холодильника и сжимают адиабатически. При этом температура газа увеличивается и достигает температуры нагревателя. Процесс повторяется сначала.
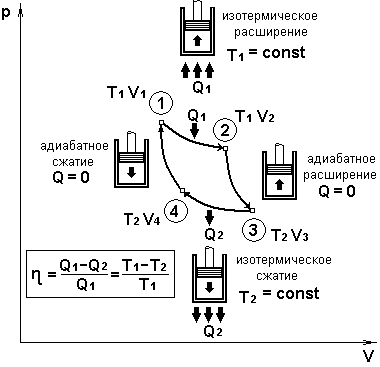
В процессе изотермического расширения 1-2 при температуре Т1 работа совершается за счет изменения внутренней энергии нагревателя, т.е. за счет подводимого к газу количества тепла http://www.germes-tech.ru подложки из нитрида кремния.
A12 = Q1
Охлаждение газа перед сжатием происходит при адиабатном расширении 2-3. Все изменение внутренней энергии при таком процессе (Q=0) преобразуется в механическую работу
A23 = - ∆U23
Температура газа в результате адиабатного расширения 2-3 понижается до температуры холодильника T2<T1.
В процессе 3-4 газ изотермически сжимается, передавая холодильнику количество теплоты Q2.
A34 = Aсж = Q2
Цикл завершается процессом адиабатного сжатия 4-1 (Q=0), при котором газ нагревается до температуры Т1.
Максимальный КПД теплового двигателя Карно
ηmax = =
Q1 – подводимое количество теплоты
Q2 – отводимое количество теплоты
Карно показал, что КПД любой другой тепловой машины (то есть с другим рабочим телом или работающей по другому циклу) будет меньше, чем КПД цикла Карно.
Любая реальная тепловая машина, работающая с нагревателем, имеющим температуру Т1, и холодильником с температурой Т2, не может иметь КПД, превышающий КПД идеальной тепловой машины.
Для повышения КПД теплового двигателя следует понижать температуру холодильника и увеличивать температуру нагревателя.
Понижать температуру холодильника искусственно невыгодно, так как это требует дополнительных затрат энергии.
Повышать температуру нагревателя можно тоже до определенного предела, так как различные материалы обладают различной жаропрочностью при высоких температурах.
Однако формула Карно показала, что существуют неиспользованные резервы повышения КПД, так как практический КПД очень сильно отличается от КПД цикла Карно.
Действительное значение КПД приблизительно равно 40%.
Двигатели Дизеля 20-40%, паровые турбины –выше 30%.
ИДЕАЛЬНЫЙ ГАЗ (уч.10кл.стр.222,229- )
Определение идеального газа, как модели(уч.10кл.стр.222)
Условия идеального газа.
Энергия молекул идеального газа
Статистические методы в модели идеального газа (уч.10кл.стр.229)
Распределение молекул идеального газа в пространстве
Микроскопические и макроскопические параметры идеального газа
Микроскопическое и макроскопическое состояние идеального газа
Распределение молекул идеального газа по скоростям (уч.10кл.стр.235)
Опыт Штерна
У разреженного газа расстояние между молекулами во много раз превышает их размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше потенциальной энергии их взаимодействия.
Для объяснения свойств вещества в газообразном состоянии вместо реального газа используется его физическая модель - идеальный газ.
В модели идеального газа предполагается:
- расстояние между молекулами чуть больше их диаметра;
- молекулы – упругие шарики;
- между молекулами не действуют силы притяжения;
- соударении молекул друг с другом и со стенками сосуда абсолютно упругое;
- движения молекул подчиняется законам механики.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало.
Принимается, что при соударениях между собой и со стенками сосуда молекулы такого газа ведут себя как абсолютно упругие шарики конечных, но весьма малых размеров.
Эти соударения происходят по законам, справедливым для абсолютно упругого удара.
Модель идеального газа можно использовать при выполнении трех условий идеального газа:
1. Диаметр молекул много меньше среднего расстояния между ними D << l Собственный объем молекул пренебрежимо мал по сравнению с объемом газа.
2. Средняя кинетическая энергия молекул больше средней потенциальной энергии их взаимодействия на расстоянии большем диаметра молекул. ![]() Это означает, что между столкновениями молекулы движутся практически по прямолинейным траекториям.
Это означает, что между столкновениями молекулы движутся практически по прямолинейным траекториям.
3. Столкновения молекул газа между собой и со стенками сосуда – абсолютно упругие. Следовательно структура электронных оболочек молекул не нарушается в результате столкновений.
Время столкновения молекул в идеальном газе значительно меньше времени их свободного пробега.
Существующие в действительности газы при не слишком низких температурах и достаточно малых давлениях.
Разреженные газы – по своим свойствам близки к идеальному газу.
СВЯЗЬ МЕЖДУ ДАВЛЕНИЕМ И СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИЕЙ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА(уч.10кл.стр.243-248)
Давление идеального газа.(Опыт с Магдебургскими полушариями)
Основное уравнение молекулярно-кинетической теории идеального газа. Его вывод и смысл.
Закон Дальтона – давление смеси идеальных газов
Молекулы газа, двигаясь со сверхзвуковыми скоростями и сталкиваясь оказывают давление на препятствия.
Давление идеального газа заключается в том, что молекулы при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела.
Найдем давление газа, находящегося в цилиндрическом сосуде, на поршень площадью S.
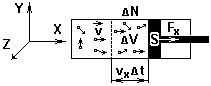
p =
Fx – результирующая сила ударов молекул о поршень
F1 – сила удара одной молекулы
∆N – полное число ударов молекул о поршень
Fx = ![]() (среднее значение)
(среднее значение)
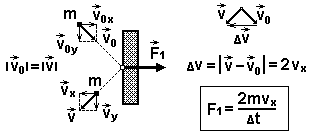
Найдем силу удара о поршень одной молекулы.
По второму закону Ньютона на молекулу со стороны поршня действует сила
![]() , где ∆v – изменение скорости молекулы за время удара ∆t
, где ∆v – изменение скорости молекулы за время удара ∆t
По третьему закону Ньютона на поршень со стороны молекулы действует сила:
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100
