Учебник по физике для поступающих в ВУЗ
![]() -средняя кинетическая энергия молекул
-средняя кинетическая энергия молекул
![]() = = - средний квадрат скорости молекулы
= = - средний квадрат скорости молекулы
Из вышеперечисленных соотношений получаем:
p = nkT
Это соотношение позволяет по двум известным макроскопическим параметрам (давлению и температуре) оценить микроскопический параметр (концентрацию молекул)
Найдем концентрацию молекул любого идеального газа при нормальных условиях:
- атмосферное давление p =1,01*105 Па
- температура 0оС (или Т = 273оК)
n = ≈ 2,7*1025 м-3
Это значение концентрации молекул идеального газа при нормальных условиях называют
постоянной Лошмидта
На основе зависимости давления газа от концентрации его молекул и температуры можно получить уравнение, связывающее все три макроскопических параметра: давление, объем и температуру - характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа.
Первый вариант вывода уравнения состояния идеального газа:
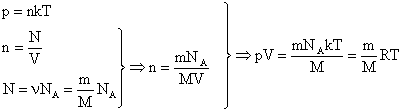
Или второй вариант вывода уравнения состояния идеального газа:
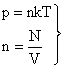 Þ pV = NkT = NkT = (kNA) T = RT
Þ pV = NkT = NkT = (kNA) T = RT
V – объем занимаемый газом
N – число частиц газа в объеме V ( N = NA)
Nma – масса газа
M = maNA – молярная масса (часто обозначают как « μ » )
k – постоянная Больцмана
R = kNA = 8,31 Дж/(моль*К) - универсальная газовая постоянная
Уравнение Клайперона-Менделеева – уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем и температуру) данной массы газа:
pV = RT
R = kNA = 8,31 Дж/(моль*К) - универсальная газовая постоянная
(произведение постоянной Больцмана на число Авогадро)
Уравнение Клайперона-Менделеева справедливо для газа любого химического состава.
От природы газа зависит только его молярная масса.
Состояние данной массы газа однозначно определяется заданием любых из двух параметров (p, V, T)
С помощью уравнения можно описать процессы сжатия, расширения, нагревание и охлаждения идеального газа.
Уравнение Клапейрона:
R = const для данной массы газа, следовательно:
=
УНИВЕРСАЛЬНАЯ ГАЗОВАЯ ПОСТОЯННАЯ(уч.10кл.стр.251- )
Уравнение Клайперона-Менделеева (см.выше уч.10кл.стр.248-251)
Молярная газовая постоянная. Смысл. Единицы измерения
R = kNA = 8,31 Дж/(моль*К) - универсальная газовая или молярная газовая постоянная
(произведение постоянной Больцмана на число Авогадро)
V – объем занимаемый газом
N – число частиц газа в объеме V ( N = NA)
Nma – масса газа
M = maNA – молярная масса
k – постоянная Больцмана
Число Авогадро NА=6,022·1023 - число атомов содержащихся в одном моле –
Моль – количество вещества, в котором содержится столько же атомов и молекул, сколько атомов содержится в углероде массой 0,012 кг.
ЖИДКОСТИ И ТВЕРДЫЕ ТЕЛА
ОСНОВНЫЕ ПОЛОЖЕНИЯ (уч.10кл.стр.307-308, 321-322)
Фазовый переход из газообразного в жидкое состояние возможен, если средняя потенциальная энергия притяжения молекул превышает их среднюю кинетическую энергию.
Для этого температура газообразного состояния (пара) должна быть ниже некоторой критической температуры.
Критическая температура – максимальная температура, при которой пар можно превратить в жидкость.
Конденсация – явление перехода пара из газообразного состояния в жидкое.
Испарение – парообразование со свободной поверхности жидкости.
При испарении жидкость охлаждается, поэтому для поддержания постоянной температуры к ней нужно подводить количество теплоты, пропорциональное массе испаряющихся молекул
Qп = r m
r – удельная теплота парообразования Дж/кг
Единица количества теплоты Дж (Джоуль)
Количество теплоты, получаемое жидкостью при конденсации, равно количеству теплоты теряемому при ее испарении
В термодинамическом равновесии число молекул пара, конденсирующихся за определенное время, равно числу молекул, испаряющихся с поверхности жидкости за это же время.
Насыщенный пар – пар, находящийся в термодинамическом равновесии со своей жидкостью.
Давление насыщенного пара при данной температуре – максимальное давление, которое может иметь пар над жидкостью при этой температуре.
Давление насыщенного пара возрастает при увеличении температуры жидкости.
Относительная влажность воздуха – процентное отношение концентрации водяного пара в воздухе к концентрации насыщенного пара при той же температуре.
Кипение – парообразование, происходящее Вов сем объеме жидкости при определенной температуре.
Температура кипения – температура, при которой давление насыщенного пара жидкости внутри пузырька начинает превосходить внешнее давление на жидкость.
Температура кипения жидкости зависит от внешнего давления и остается постоянной в процессе кипения.
Поверхностное натяжение – явление молекулярного давления на жидкость, вызванное притяжением молекул поверхностного слоя в к молекулам внутри жидкости.
Поверхностная энергия – дополнительная энергия молекул поверхностного слоя жидкости.
Сила поверхностного натяжения – сила, направленная по касательной к поверхности жидкости, перпендикулярно участку контура, ограничивающего поверхность, в сторону ее сокращения
Fпов = σ l
l – длина участка поверхностного слоя
σ – поверхностное натяжение Н/м
Единица поверхностного натяжения – Н/м
Смачивание – искривление поверхности жидкости у поверхности твердого тела в результате взаимодействия молекул жидкости с молекулами твердого тела.
Жидкость смачивает поверхность, если силы притяжения между молекулами жидкости меньше сил притяжения между молекулами жидкости и твердого тела.
Мениск – форма поверхности жидкости вблизи стенок сосуда.
Угол смачивания – угол между плоскостью, касательной к поверхности жидкости и стенкой сосуда.
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100
