Кристаллы в природе
II Силы взаимодействия и строение кристаллов
2.1.Природа сил связи в кристаллах.
Различные типы кристаллов и возможное расположение узлов (точка, относительно которой атом (молекула) совершает колебания) в пространственной решётке изучает кристаллография. По характеру сил, которые действуют между частицами, находящимися в узлах решётки кристалла, различают четыре типичные кристаллические структуры: ионную, атомную, молекулярную и металлическую.
ИОННАЯ кристаллическая структура характеризуется наличием положительных и отрицательных ионов в узлах решётки. Силами, которые удерживают ионы в узлах такой решётки, являются силы электрического притяжения и отталкивания между этими ионами.
Разноимённо заряжённые ионы в ионной решётке расположены ближе друг другу, чем одноимённо заряжённые, поэтому силы притяжения между ионами решётки преобладают над силами отталкивания. Этим и обуславливается значительная прочность кристаллов с ионной решёткой (рис10).
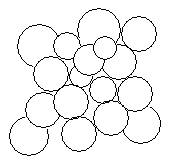
рис. 10
При плавлении веществ с ионной кристаллической решёткой из узлов решётки в расплав переходят ионы, которые становятся свободными носителями зарядов. Поэтому такие расплавы являются хорошими проводниками электрического тока.
АТОМНАЯ кристаллическая структура характеризуется наличием нейтральных атомов в узлах решётки, между которыми имеется ковалентная связь.
Современный уровень физики позволяет рассчитать вероятность пребывания электрона в то или иной области пространства, занятого атомом. Эту область пространства можно изобразить в виде электронного облака, которое гуще там, где электрон бывает чаще, т.е. где больше вероятность пребывания электрона (рис 11).
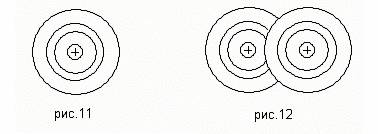
Электронные облака валентных электронов двух атомов, образующих молекулу с ковалентной связью, перекрываются, оба валентных электрона (по одному от каждого атома) обобществляются, т.е. принадлежат обоим атомам одновременно, и большую часть времени проводят между атомами, связывая их в молекулу (рис 12).Эта связь сильная.
МОЛЕКУЛЯРНАЯ кристаллическая структура отличается пространственной решёткой, в узлах которой находятся нейтральные молекулы вещества. Силами, удерживающими молекулы в узлах этой решётки, являются силы межмолекулярного взаимодействия. Эти силы слабые. Твёрдые вещества с молекулярной решёткой легко разрушаются при механическом воздействии и имеют низкую температуру плавления. Примерами веществ с молекулярной пространственной решёткой является нафталин, твёрдый азот и большинство органических соединений.
МЕТАЛЛИЧЕСКАЯ кристаллическая структура отличается наличием в узлах решётки положительно заряженных ионов металла. У атомов всех металлов валентные электроны, т.е. наиболее удалённые от ядра атома, очень слабо связаны с атомами. Электронные облака таких периферийных электронов перекрывают сразу много атомов в кристаллической решётке металла. Это означает, что валентные электроны в кристаллической решётке металла не могут принадлежать одному и даже двум атомам, а обобществляются сразу многими атомами. Такие электроны практически могут беспрепятственно двигаться между атомами.
Таким образом, каждый атом в твёрдом металле теряет свои периферийные электроны, и атомы превращаются в положительно заряженные ионы, а оторвавшиеся от них электроны движутся между ионами по всему объёму, занятому кристаллом.
Что же касается вандерваальсовой связи, то она всегда примешивается к ионно-ковалентной связи. Ведь хотя внутренние оболочки всех атомов всегда заполнены, вследствие движения электронов центр их отрицательного заряда может не совпадать с центром положительно заряжённого ядра.
2.2.Структура кристаллов
Для ионных, металлических и вандерваальсовых сил взаимодействия характерны их симметричность силы связи в молекулярных и металлических кристаллах.
Симметричный характер сил связи приводит к тому, что ионы оказываются плотно упакованными. Расположения частиц в таких кристаллах подобно плотной упаковки шаров в некотором объёме. Для того чтобы разобраться в структуре кристаллов, рассмотрим законы плотной упаковки шаров.
Остановимся на случае, когда все шары одинаковы. Первый слой шаров можно уложить плотно единственным образом так, как показано на рисунке 13. Каждый шар имеет при этом 6 соседей.
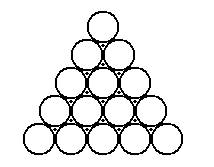
рис. 13
Шары второго слоя, для того чтобы они легли наиболее плотно, должно быть помещены в лунки первого слоя. Заполнить все лунки шарами того же самого размера нельзя, поэтому лунки заполняются через одну. Предположим, лунки отмеченные крестиком, остались пустыми, а лунки, отмеченные точками, заполнены шарами, очевидно, характер плотной упаковки не изменился бы, если бы шарами заполнили лунки, отмеченные крестиком.
Плотную упаковку из трёх слоёв можно сделать двумя различными способами. Действительно, чтобы получить плотнейшую упаковку, мы должны укладывать шары третьего слоя в лунки второго слоя. Однако шары третьего слоя при этом можно расположить либо так, что центры их будут лежать над лунками первого слоя, либо так, чтобы центры их лежали над центрами шаров первого слоя. Эти две трёхслойные постройки имеют одинаковую плотность упаковки, но структурно они отличаются друг от друга. Первой из них соответствует гранецентрированная кубическая элементарная ячейка, второй - гексанальная. При этом каждый атом, находящийся внутри упаковки, имеет 12 соседей.
2.3. Структура атомных кристаллов
Молекулярные, ионные и металлические кристаллы имеют плотноупакованные структуры вследствие того, что силы связи имеют симметричный характер. Кроме того, для этих сил не существует предельного числа атомов, на которые они могут действовать.
Ковалентные связи имеют совершенно другой характер. Они определяют число возможных «соседей» атома в кристалле и носят, кроме того, направленный характер. Например, атом углерода в кристалле может иметь только четырёх соседей, ибо он может образовывать только четыре ковалентные связи с окружающими его атомами. Кроме того, электронные облака валентных электронов имеют определённое расположение в пространстве; при «обобществлении» электронов электронные облака, частично перекрываясь, выстраиваются в цепочку и вынуждают атомы занять вполне определённое положение в пространстве. В результате каждый атом углерода оказывается в вершине правильного тетраэдра. Таким образом, структура атомных кристаллов не является плотноупакованной. Она определяется числом и видом ненасыщенных связей атомов.
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29
