Экспериментальные термометрические шкалы и методы измерения температур - Курсовая работа
Для устранения этой проблемы можно взять какой – либо термометр за основной, а остальные термометры градуировать по нему. Таким термометром оказался газовый термометр и, связанная с ним идеально – газовая шкала температур.
Идеально – газовая шкала температур. Купить доску сухую из ясеня: ясень дерево купить доска artwoodbase.ru.
Построение идеально – газовой шкалы температур производиться с помощью закона Бойля – Мариотта: произведение давления идеального газа данной массы на его объём зависит только от температуры газа:
PV = CT,
где С – постоянная, зависящая от массы и химической природы рабочего газа.
Преимущество этой шкалы в том, что как показали эксперименты, постоянная С очень слабо зависит от химической природы газа. Температуры тела, измеренные с помощью газовых термометров с различными рабочими газами, были очень близки друг к другу.
Газовый термометр можно реализовать двумя способами:
Зафиксировать объём газа и в качестве индикатора температуры принять давление газа.
Зафиксировать давление газа, в качестве индикатора температуры взять объём.
Оба способа равноправны, но первый более удобный, и поэтому он используется чаще.
Устройство этого газового термометра можно изобразить таким:
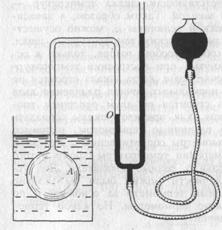
рис. 1
Газовый термометр представляет собой стеклянный, кварцевый или металлический баллон неизменного объема, заполненный реальным газом и соединённый с помощью капилляра с манометром. Уровень ртути в левом колене манометра доводится до отметки О, чтобы обеспечить постоянство объёма газа. В качестве рабочего раза раньше употреблялся водород. Сейчас же в основном употребляется гелий (для измерения низких и средних температур) и азот (для измерения высоких температур, где гелий не пригоден, т.к. он легко диффундирует сквозь стенки баллона). Давление газа измеряется по манометру, и затем, по этому давлению вычисляется температура с учётом поправок на изменение объёма баллона, неидеальность газа и пр.
Несмотря на кажущуюся простоту измерение температуры с помощью газового термометра – нелёгкая экспериментальная работа, требующая от экспериментатора особой тщательности. Поэтому в повседневной жизни пользуются другими типами термометров. Идеально – газовым термометром пользуются в исключительных случаях, когда нужна высокая точность измерения температуры.
Интервал, измеряемых газовым термометром, температур ограничен. Это связано с тем, что все реальные газы при очень низких температурах конденсируются и далее уже не подчиняются закону Бойля – Мариотта. Точно также при очень высоких температурах молекулы газа начинают диссоциировать (распадаться) на электроны и положительно заряженные ионы и также перестают подчиняться закону Бойля – Мариотта.
Но всё же там, где пригодна газовая шкала, она практически не отличается от шкалы Кельвина. Поэтому в интервале температур от 4 К до 1338 К абсолютная термодинамическая шкала осуществляется именно с помощью газового термометра.
Газовая шкала, хотя и слабо, но всё же зависит от природы рабочего газа. Рациональная температурная шкала не должна зависеть от свойств термометрического вещества. Этим требованиям удовлетворяет абсолютная термодинамическая шкала Кельвина. Хотя она и не относится к экспериментальным шкалам, но она так важна в физике, что я посчитал необходимым упомянуть и её.
Термодинамическая абсолютная шкала Кельвина.
В 1848 г. Вильям Томсон (лорд Кельвин) указал, что теоремой Карно можно воспользоваться для построения рациональной температурной шкалы, совершенно не зависящей от индивидуальных особенностей термометрического вещества и устройства термометра.
Из теоремы Карно следует, что КПД цикла Карно может зависеть только от температур нагревателя и холодильника. Обозначим буквами t1 и t2 эмпирические температуры нагревателя и холодильника, измеренные каким-либо термометром (например, газовым, ртутным, термометром сопротивления и т. п.). Тогда
![]()
где f(t1, t2) — универсальная функция выбранных эмпирических температур t1 и t2. Ее вид совершенно не зависит от устройства машины Карно и от рода используемого рабочего вещества. Этим обстоятельством и воспользовался Вильям Томсон, предложивший применить цикл Карно для построения температурной шкалы.
Чтобы построить термодинамическую шкалу температур, введем более простую универсальную функцию температур t1 и t2:
![]()
Эта функция легко выражается через прежнюю функцию f(t1,, t2). Определим общий вид функции φ(t1,, t2). С этой целью возьмем три тепловых резервуара, температуры которых поддерживаются постоянными. Эмпирические температуры этих резервуаров обозначим через t1, t2, t3 соответственно. Используя их в качестве нагревателей и холодильников, проведем три цикла Карно, изображенные на рис. 26.
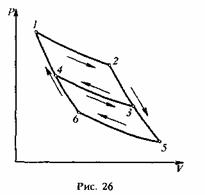
Предполагается, что t1, t2, t3 — температуры на изотермах 12, 43, 65. Для циклов Карно 1234 и 4356 можно написать
![]()
Исключив отсюда теплоту Q2, получим
![]()
Но эти два цикла, объединенные вместе по схеме рис. 26, эквивалентны одному циклу Карно 1256. Это
происходит потому, что по изотерме 43 мы проходим дважды в противоположных направлениях, и она может быть исключена из рассмотрения. Следовательно,
![]()
Сравнивая это соотношение с предыдущим, получим
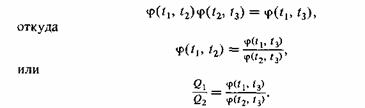
Такое соотношение справедливо при любом значении аргумента t3. Левая часть его не зависит от значения температуры t3. Поэтому и отношение в правой части не может меняться с изменением t3. Можно фиксировать t3 , не меняя значения самого отношения. Но тогда числитель в правой части формулы (31.5) будет функцией одного только аргумента t1. Обозначим эту функцию через Θ(t1). Знаменатель будет такой же функцией, но от аргумента t2.
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11
