Сжижение газов
СОДЕРЖАНИЕ:
1. Газы и сжижение газов.
2. Адиабатный процесс.
3. Низкие температуры.
4. Измерение криогенных температур.
5. Криогенная техника.
6. Физика низких температур.
7. Технические приложения низких температур.
8. Каскадный метод охлаждения как один из методов сжижения газов.
9. Литература.
Газы (французское gaz; название предложено голландским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Газы обладают рядом характерных свойств. В отличие от твёрдых тел и жидкостей, объём газы существенно зависит от давления и температуры.
Диаграмма состояния вещества рис.1:
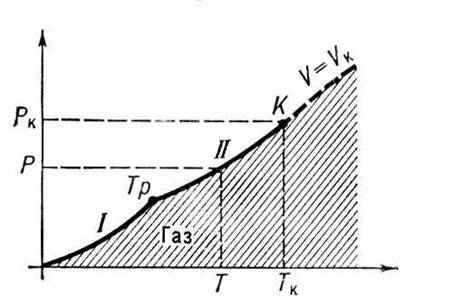 |
При температурах ниже Тк можно сконденсировать газ. - перевести его в др. агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение газа в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности, теплоёмкости и др.). Процессы конденсации газа имеют важное техническое значение.
При Т > Тк граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между газом. и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору вещества (кривую постоянной плотности или удельного объёма, см. рис. 4), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
В связи с тем что область газового состояния очень обширна, свойства газов при изменении температуры и давления могут меняться в широких пределах.
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать газом, обладает огромной плотностью (например, в центре некоторых звёзд ~109 г/см3). В зависимости от условий в широких пределах изменяются и др. свойства газов - теплопроводность, вязкость и т. д.
Сжижение газов - переход вещества из газообразного состояния в жидкое. Оно достигается охлаждением их ниже критической температуры (Тк) и последующей конденсацией в результате отвода теплоты парообразования (конденсации).
Охлаждение газа ниже ТК необходимо для достижения области температур, при которых газ может сконденсироваться в жидкость (при Т > ТК жидкость существовать не может). Впервые газ (аммиак) был сжижен в 1792 (голландский физик М. ван Марум). Хлор был получен в жидком состоянии в 1823 (М.Фарадей), кислород — в 1877 (швейцарский учёный Р. Пикте и французский учёный Л. П. Кальете), азот и окись углерода — в 1883 (З. Ф. Вроблевский и К.Ольшевский) водород — в 1898 (Дж. Дьюар), гелий — в 1908 (Х. Камерлинг-Оннес).
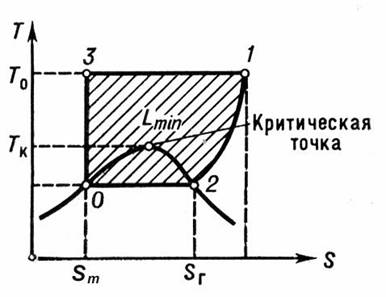 Идеальный процесс сжижения газов изображен на рис. 2.
Идеальный процесс сжижения газов изображен на рис. 2.
Рис.2
Изобара 1—2 соответствует охлаждению газа до начала конденсации,
изотерма 2—0 — конденсации газа.
Площадь ниже 1—2—0 эквивалентна количеству теплоты, которое необходимо отвести от газа при его сжижении, а площадь внутри контура 1—2—0—3 (1—3 — изотермическое сжатие газа,
3—0 — адиабатическое его расширение) характеризует термодинамически минимальную работу Lmin, необходимую для сжижения газа.
Lmin = T0(SГ — SЖ) — (JГ - JЖ),
где T0 — температура окружающей среды; SГ, SЖ — энтропии газа и жидкости; JГ, JЖ — теплосодержания (энтальпии) газа и жидкости.
Значения Lmin и действительно затрачиваемой работы LД для сжижения ряда газов даны в таблице.
Промышленное сжижение газа с критической температурой ТК выше температуры окружающей среды (например, аммиак, хлор) осуществляется с помощью компрессора, где газ сжимается, и последующей конденсацией газа в теплообменниках, охлаждаемых водой или холодильным рассолом. Сжижения газа с ТК, которая значительно ниже температуры окружающей среды, производится методами глубокого охлаждения. Наиболее часто для сжижения газа. с низким ТК применяются холодильные циклы, основанные на дросселировании сжатого газа (использование Джоуля — Томсона эффекта), на расширении сжатого газа с производством внешней работы в детандере, на расширении газа из постоянного объёма без совершения внешней работы (метод теплового насоса). В лабораторной практике иногда используется каскадный метод охлаждения (сжижения).
Графическое изображение и схема дроссельного цикла сжижения газа дана на рис. 3.
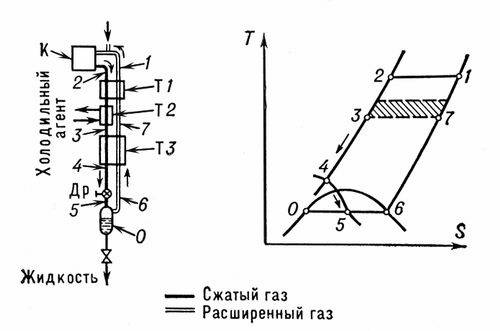 Рис.3
Рис.3
После сжатия в компрессоре (1—2) газ последовательно охлаждается в теплообменниках (2—3—4) и затем расширяется (дросселируется) в вентиле (4—5). При этом часть газа сжижается и скапливается в сборнике, а несжижившийся газ направляется в теплообменники и охлаждает свежие порции сжатого газа. Для сжижения газа по циклу с дросселированием необходимо, чтобы температура сжатого газа перед входом в основной теплообменник T3 была ниже температуры инверсионной точки. Для этого и служит теплообменник с посторонним холодильным агентом T2. Если температура инверсионной точки газа лежит выше комнатной (азот, аргон, кислород), то схема принципиально работоспособна и без теплообменников T1 и T2. Применение посторонних хладагентов в этих случаях имеет целью повышение выхода жидкости. Если же температура инверсионной точки газа ниже комнатной, то теплообменник с посторонним хладагентом обязателен. Например, при сжижении водорода методом дросселирования в качестве постороннего хладагента используется жидкий азот, при сжижении гелия — жидкий водород.
Перейти на страницу: 1 2 3 4 5 6
