Свойства газов
Как истолковать закон Дальтона с точки зрения молекулярной теории, скажу немного далее.
Плотности газов
Плотность газа является одной из важнейших характеристик его свойств. Говоря о плотности газа, обычно имеют в виду его плотность при нормальных условиях (т. е. при температуре 0° С и давлении 760 мм рт. ст.). Кроме того, часто пользуются относительной плотностью газа, под которой подразумевают отношение плотности данного газа к плотности воздуха при тех же условиях. Легко видеть, что относительная плотность газа не зависит от условий, в которых он находится, так как согласно законам газового состояния объемы всех газов меняются при изменениях давления и температуры одинаково.
Плотности некоторых газов
Газ Плотность при нормальных условиях в г/л или в кг/м3 Отношение к плотности воздуха Отношение к плотности водорода Молекулярный или атомный вес
Воздух 1,293
0,0899 1,25 1,43 1,977 0,179 1
0,0695 0,967 1.11 1,53 0,139 14,5
1 14 16 22 2 29 (средний)
Водород (Н2) 0,0899 0,0695 1 2
Азот (N2) 1,25 0,967 14 28
Кислород (О2) 1,43 1,11 16 32
Углекислый газ (СО2) 1,977 1,53 22 44
Гелий (Не) 0,179 0,139 2 4
Определение плотности газа можно осуществить так. Взвесим колбу с краном дважды: один раз откачав из нее по возможности полностью воздух, другой раз наполнив колбу исследуемым газом до давления, которое должно быть известно. Разделив разность весов на объем колбы, который надо определить предварительно, найдем плотность газа при данных условиях. Затем, пользуясь уравнением состояния газов, легко найдем плотность газа при нормальных условиях dн. Действительно, положим в формуле (10) Р2=Рн, V2=Vн, Т2=Тн и, умножив числитель и знаменатель
формулы на массу газа m, получим:
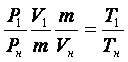
Отсюда, принимая во внимание,(m/v1)=d1, и (m/v)=dн находим:
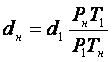
Результаты измерений плотности некоторых газов приведены в таблице выше.
Последние два столбца указывают на пропорциональность между плотностью газа и его молекулярным весом (в случае гелия — атомным весом).
Закон Авогадро
Сравнивая числа предпоследнего столбца таблицы с молекулярными весами рассматриваемых газов, легко заметить, что плотности газов при одинаковых условиях пропорциональны их молекулярным весам. Из этого факта следует весьма существенный вывод. Так как молекулярные веса относятся как массы молекул, то
d1/d2=m1/m2, где d – плотность газов, а m – массы их молекул.
массы их молекул. С другой стороны, массы газов М1 и М2, заключенных в одинаковых объемах V, относятся как плотности их:
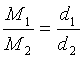 (11)
(11)
обозначив числа молекул первого и второго газов, заключенных в объеме V, буквами N1 и N2, можем написать, что общая масса газа равна массе одной его молекулы, умноженной на число молекул: М1=т1N1 и М2=т2N2 поэтому
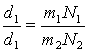
Сопоставляя этот результат с формулой d1/d2=m1/m2 , найдем,
что N1=N2. Итак, при одинаковых, давлении и температуре равные объемы различных газов содержат одинаковые числа молекул.
Этот закон был открыт итальянским химиком Амедео Авогадро (1776—1856) на основании химических исследований. Он относится к газам, сжатым не очень сильно (например, к газам под атмосферным давлением). В случае сильно сжатых газов считать его справедливым нельзя.
Закон Авогадро означает, что давление газа при определенной температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы тяжелые или легкие. Уяснив это, легко понять суть закона Дальтона. Согласно закону Бойля — Мариотта, если мы увеличиваем плотность газа, т. е. добавляем в определенный объем некоторое число молекул этого газа, мы увеличиваем давление газа. Но согласно закону Авогадро, такое же повышение давления должно быть получено, если мы вместо добавления молекул первого газа добавим такое же число молекул другого газа. Именно в этом и состоит закон Дальтона, который утверждает, что можно увеличить давление газа, добавляя в тот же объем молекулы другого газа, и если число добавленных молекул то же, что и в первом случае, то получится то же самое увеличение давления. Ясно, что закон Дальтона является прямым следствием закона Авогадро.
Грамм-молекула. Число Авогадро.
Число, дающее отношение масс двух молекул, указывает в то же время и отношение масс двух порций вещества, содержащих одинаковые числа молекул. Поэтому 2 г водорода (молекулярный вес На равен 2), 32 г кислорода (молекулярный вес Од равен 32) и 55,8 г железа (его молекулярный вес совпадает с атомным, равным 55,8) и т. д. содержат одно и то же число молекул.
Количество вещества, содержащее число граммов, равное его молекулярному весу, называется грамм-молекулой или молем.
Из сказанного вытекает, что моли разных веществ содержат одно и то же число молекул. Поэтому часто оказывается удобным пользоваться молем как особой единицей, содержащей разное число граммов для различных веществ, но одинаковое число молекул.
Число молекул в одном моле вещества, получившее название числа Авогадро, является важной физической величиной. Для определения числа Авогадро были сделаны многочисленные и разнообразные исследования. Они относятся к броуновскому движению, к явлениям электролиза и ряду Других. Эти исследования привели к довольно согласным результатам. В настоящее время принимают, что число Авогадро равно
N= 6,02*1023 моль-1.
Итак, 2 г водорода, 32 г кислорода и т. д. содержат по 6,02*1023 молекул. Чтобы представить себе громадность этого числа, вообразим пустыню площадью в 1 миллион квадратных километров, покрытую слоем песка толщиной 600 м. Тогда, если на каждую песчинку приходится объем 1 мм3, то общее число песчинок в пустыне будет равно числу Авогадро.
Перейти на страницу: 1 2 3 4 5 6 7 8
