Реальные газы
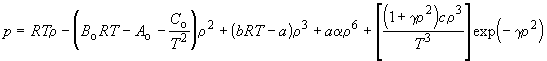
Модельные представления о реальных газах.
Рассмотрим две простые модели, которые позволят учесть эти факторы при расчете статистической суммы газа.
Модель решеточного газа
В модели решеточного газа предполагается, что N различимых частиц движутся в объеме V, разделенном на ячейки объемом b, при этом число ячеек n = V / b предполагается намного большим, чем число частиц, т.е. большинство ячеек - пустые (рис. 2.1). В каждой ячейке может находиться не более одной частицы (если в одной ячейке находятся две частицы, то потенциальная энергия принимается равной +Ґ ). Частицы, находящиеся в разных ячейках, не взаимодействуют, т.е. потенциальная энергия равна 0. Фактически, в этой модели объем ячейки - это собственный объем частиц. Найдем уравнение состояния для решеточного газа.
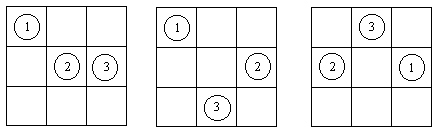
Рис. 2.1. Три из 504 вариантов расположения трех различимых частиц в 9 ячейках.
![]()
Из этого уравнения состояния следует то, что ![]() при любых объемах. Это означает, что решеточный газ без взаимодействия ни при каких условиях не проявляет критического поведения и наличие собственного объема, которое можно рассматривать как существование бесконечного отталкивания на малых расстояниях, само по себе не может приводить к конденсации газа.
при любых объемах. Это означает, что решеточный газ без взаимодействия ни при каких условиях не проявляет критического поведения и наличие собственного объема, которое можно рассматривать как существование бесконечного отталкивания на малых расстояниях, само по себе не может приводить к конденсации газа.
Модель решеточного газа с взаимодействием
Для того, чтобы оценить роль межчастичного взаимодействия в поведении реальных газов, рассмотрим модель решеточного газа с притяжением, в котором каждая пара частиц взаимодействует друг с другом с одинаковым потенциалом, равным –2a/V, где a - постоянная, V - объем газа.
![]() ;
; 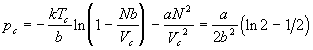 ;
;
![]()
Главный вывод, который следует из рассмотрения двух моделей решеточного газа состоит в том, что критические явления в реальном газе могут появляться только в том случае, когда потенциал взаимодействия содержит как отталкивательную часть (на малых, но конечных расстояниях), так и притягивающую часть.
Заключение.
Данная курсовая работа посвящена рассмотрению реальных газов с точки зрения физики и физической химии. В ней рассмотрены принципы описания свойств реальных при высоких давлениях и низких температурах, когда классическое уравнение состояния Клайперона-Менделеева уже не имеет смысла.
Это происходит при увеличение давления, когда расстояние между молекулами начинает сокращаться и они взаимодействуют между собой, что приводит нас к выводу вириальных коэффициэнтов, которые характеризуют потенциалы парных, тройных и т.д. межмолекулярных взаимодействий.
Учет этих взаимодействий позволяет не только точно рассчитывать рассличные характерные свойства газов, но также и их калорические характеристики, например теплоемкость, при учете которой, также необходимо знать размеры молекул атомов и потенциалы межмолекулярных взаимодействий.
Список литературы
1. Савельев «Курс общей физики». Учебное пособие для ВТузов. Молекулярная физика. Первый том.
2. И. И. Новиков «Термодинамика.» 1984.
3. Т.И.Трофимова «Курс общей физики». Молекулярная физика. Лекции.
4. К.В.Глаголев «Физическая термодинамика». Том второй.
5. А.Н.Морозов. МГТУ им. Н.Б.Баумана. 2002г.
6. В.В. Еремин, С.И. Каргов, Н.Е. Кузьменко «Реальные газы.» 1998
7. Р.Кубо «Термодинамика.» 1989.
Перейти на страницу: 1 2 3 4 5 6
