Молекулярно-кинетическая теория
|
Молекулярно-кинетическая теория идеальных газов | |||||||||
|
Тепловое равновесие. Температура. Шкала температур Цельсия. Молекулярная физика и термодинамика изучают свойства и поведение макроскопических систем, т.е. систем, состоящих из огромного числа атомов и молекул. Типичные системы, с которыми мы сталкиваемся в повседневной жизни, содержат около 1025 атомов. При исследовании таких систем важнейшими являются макроскопические величины, непосредственно измеряемые опытным путём и характеризующие свойства всей совокупности молекул в целом. Учитывая необычайную сложность макросистем, следует начать изучение с наиболее простых объектов – систем, состояние которых не меняется со временем. Состояние макроскопической системы, в котором она может находится неопределённо долгое время, называется равновесным (о нём говорят также, как о состоянии теплового равновесия). | |||||||||
|
|
Равновесное состояние системы в целом может быть описано при помощи величин, называемых макроскопическими параметрами, к числу которых относят давление, объем и т. д. Каждый из параметров характеризует некоторое свойство системы. Так объем V мера свойства системы занимать ту или иную область пространства; давление Р – мера свойства системы сопротивляться внешнему изменению ее объёма. В состоянии теплового равновесия макроскопические параметры не меняются со временем, остаются постоянным. Одним из наиболее важных параметров, характеризующих равновесные свойства макроскопической системы, является температура. Введем этот параметр, для чего рассмотрим два тела, которые могут взаимодействовать и обмениваться энергией. Этот тип взаимодействия, который называется тепловым, приводит к тому, что в результате столкновений молекул в области контакта двух тел происходит передача энергии от быстрых молекул к медленным. Это означает, что энергия движения атомов в одном теле уменьшается, в другом – увеличивается. Тело, которое теряет энергию, называют более нагретым, а тело, к которому энергия переходит – менее нагретым. Такой переход энергии продолжается до тех пор, пока не установится состояние теплового равновесия. В состоянии теплового равновесия степени нагретости тел одинаковы. Для характеристики степени нагретости тела вводят параметр, называемый температурой. Из опыта известно, что при изменении температуры изменяются размеры тел, электрическое сопротивление и другие свойства. Таким образом, температуру можно определить по изменению какого-либо удобного для измерения физического свойства данного вещества. Чаще всего для измерения температур используют свойство жидкости изменять объем при нагревании и охлаждении. Прибор, с помощью которого измеряется температура, называется термометром. | ||||||||
|
|
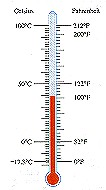
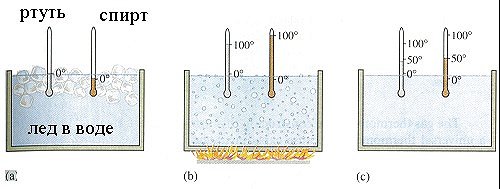
Обыкновенный жидкостной термометр состоит из небольшого стеклянного резервуара, к которому присоединена стеклянная трубка с узким внутренним каналом. Резервуар и часть трубки наполнены ртутью или другой жидкостью. Температуру среды, в которую погружен термометр, определяют по положению верхнего уровня ртути в трубке. Деления на шкале условились наносить следующим образом. Цифру 0 ставят в том месте шкалы, где устанавливается уровень столбика жидкости, когда термометр опущен в тающий снег, цифру 100 – в том месте, где устанавливается уровень столбика жидкости, когда термометр погружен в пары воды, кипящей при нормальном давлении (105 Па). Расстояние между этими метками делят на 100 равных частей, называемых градусами. Такая температурная шкала создана Цельсием. Градус по шкале Цельсия обозначают °С.
Кроме макроскопических параметров вводят параметры системы, связанные с индивидуальными характеристиками составляющих её частиц, называемые микроскопическими. К их числу относятся в первую очередь масса частиц, их скорость, кинетическая энергия. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа. Теория создана немецким физиком Р. Клаузисом в 1957 году для модели реального газа, которая называется идеальный газ. Основные признаки модели:
| ||||||||
|
|
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ. Рассмотрим сферический объём радиуса R, в котором находится N молекул идеального газа. Рассмотрим движение одной из них. Допустим, что молекула двигалась прямолинейно с импульсом
Т. к. удар упругий,
Путь, который молекула проходит от одного удара о стенку до другого, равен хорде АВ, т. е. величине 2Rcosψ. Найдем число ударов молекулы о стенку за одну секунду. Оно равно отношению скорости молекулы
Сталкиваясь со стенками сосуда, одна молекула за одну секунду сообщает ей импульс
Суммарный импульс, сообщенный всеми N молекулами стенке сосуда за одну секунду будет равен
Из II закона Ньютона следует, что импульс, сообщённый за единицу времени стенке, численно равен силе, поэтому сила давления, действующая на поверхность сосуда, равна
Давление найдём, разделив силу на площадь поверхности сферического сосуда:
где Перепишем полученное равенство в виде:
Помножив и поделив правую часть на число молекул N в объёме V, получим:
Здесь введена величина
Тогда
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа. Получим связь давления со средней кинетической энергией поступательного движения молекулы
Из формулы (11)
Таким образом, давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа. Закон Дальтона. Рассмотрим газ, состоящий из молекул различных веществ, который находится в объёме V. Вследствие хаотического теплового движения молекулы каждой компоненты смеси будут распределены по объёму равномерно, т.е. так как если бы остальные компоненты газа отсутствовали. Из–за постоянных соударений молекул друг с другом, сопровождающихся частичным обменом между ними импульсами и энергиями, в смеси устанавливается тепловое равновесие. Всё это приводит к тому, что давление каждой из компонент смеси не будет зависеть от присутствия остальных. Тогда результирующее давление определяется суммарным давлением всех компонентов, т.е. для смеси газов справедлив закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов.
Средняя квадратичная скорость молекул. Из основного уравнения молекулярно-кинетической теории можно получить формулу для расчета средней квадратичной скорости молекул
Произведение массы одной молекулы m0 на число молекул в единице объема n равно плотности вещества r : =r m0×n. Таким образом,
| ||||||||



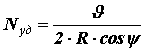 .
.
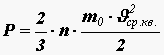
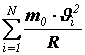 .
.
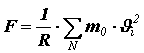 .
.
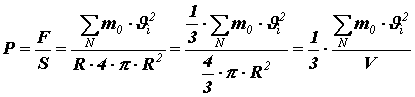 ,
,
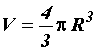 – объём сосуда с газом.
– объём сосуда с газом.
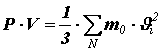
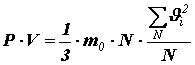 или
или 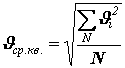 . (10)
. (10)
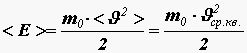 . (12)
. (12)
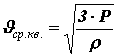 . (15)
. (15)